一、简介
质谱法 (MS) 是一种用于测量离子质荷比 (m/z) 的分析技术。它通过分析分子质量来识别样品的成分。MS 用途广泛,可用于分析各种化合物,包括小有机分子、大蛋白质,甚至复杂的生物分子。该技术在定性和定量分析中都发挥着至关重要的作用,使科学家能够确定物质的结构、分子量和化学成分。
在质谱分析中,样品被电离,然后根据其m/z比分离并检测离子。该信息用于生成质谱图,即以图形方式显示检测到的离子的相对丰度。质谱图上的每个峰对应于分析物的一个片段,这些峰的分布有助于识别化合物的化学结构和分子量。
质谱法是化学、生物化学、制药和结构生物学等多个领域的有力工具。它常用于分子鉴定、同位素分析、研究复杂混合物以及阐明蛋白质结构。
二、质谱分析的历史
质谱法起源于20世纪初,当时英国物理学家JJ Thomson发明了一种测量带电粒子质量的方法,并于1913年用它来鉴定氖的同位素。Thomson的技术,即“抛物线法”,利用磁场和电场,根据质荷比分离离子。后来,Francis W. Aston改进了Thomson的工作,发明了第一台现代质谱仪,并由此发现了许多天然存在的同位素。Aston因其贡献,于1922年获得了诺贝尔化学奖。
20世纪中期,真空系统、电离技术和检测方法等技术进步彻底改变了质谱分析技术。尤其是1953年AJ Dempster发明的电子电离(EI)技术,提供了一种更高效的分子电离方法。这项技术进步,加上四极杆质谱仪、飞行时间(TOF)检测器和串联质谱(MS/MS)技术的发展,显著提高了质谱分析技术的精度和灵敏度。
近几十年来最重要的进展包括电喷雾电离 (ESI)和基质辅助激光解吸/电离 (MALDI)的发明,这两项技术使得分析蛋白质和核酸等大型生物分子成为可能。这些突破使质谱技术成为蛋白质组学、基因组学和结构生物学领域的基石。
三、质谱原理与仪器
质谱法的工作原理是将分子电离,根据质荷比分离产生的离子,然后对其进行检测,生成质谱。质谱仪的关键部件包括离子源、质量分析器和检测器。
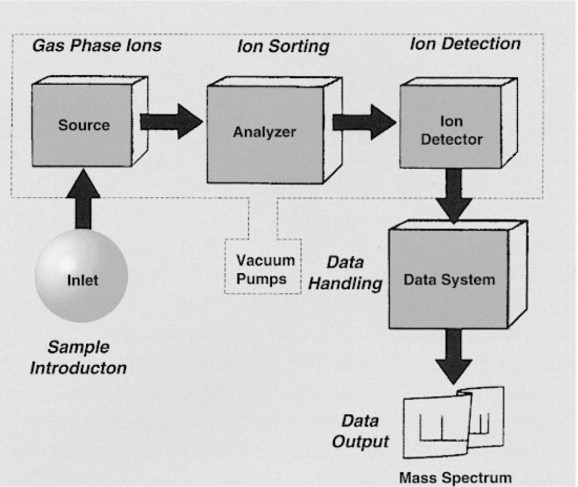
图 1. 质谱仪的组成部分
2.1离子源
质谱分析的第一步是电离,将样品转化为带电粒子。根据样品的性质,可以通过各种电离技术实现电离。常见的电离方法包括:
- 电子电离 (EI):EI 通常用于小型挥发性分子,它用电子流轰击样品,使其失去电子并形成带正电的离子。
- 电喷雾电离 (ESI):ESI 用于分析蛋白质等大型生物分子。该方法通过高压针喷射样品,形成带电液滴,液滴蒸发后,留下气相中的带电离子。
- 基质辅助激光解吸/电离 (MALDI):在 MALDI 中,样品与基质材料混合,并用激光照射。激光能量被基质吸收,导致分析物形成离子。
2.2质量分析器
样品电离后,离子会被送入质量分析仪,并根据其m/z比进行分离。最常见的质量分析仪类型包括:
- 四极杆质量分析器:该装置使用四根平行的杆来产生振荡电场,选择性地允许特定 m/z 比的离子通过,而其他离子则被过滤掉。
- 离子阱:离子阱利用电场和磁场将离子限制在狭小的空间内。然后,离子被依次释放,并根据其质荷比进行检测。
- Orbitrap:Orbitrap 分析仪在静电场中捕获离子并测量其振荡频率,该频率与 m/z 比成比例。
- 飞行时间 (TOF) 分析仪:在 TOF 分析仪中,离子被电场加速,并测量其到达检测器的时间。由于质量较小的离子飞行速度较快,这种方法可以精确测定其质荷比 (m/z)。
2.3探测器
离子经质谱仪分离后,被送至检测器,检测器记录每个质荷比下的离子数量和强度。常见的检测器包括电子倍增器和微通道板,它们将离子撞击转换成电信号,经处理后生成质谱图。
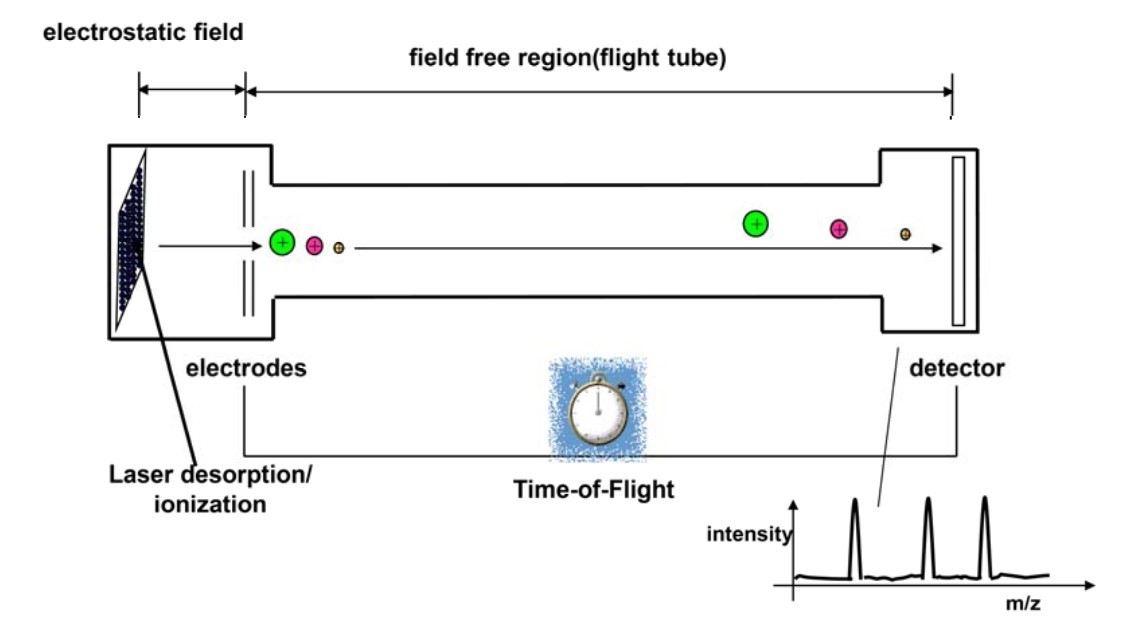
图 2.使用飞行时间质谱分析仪进行 MALDI 分析
三、分离技术与质谱联用
质谱法通常与各种分离技术结合使用,以提高复杂混合物的分辨率和分析能力。最常见的组合包括:
3.1气相色谱-质谱法 (GC-MS):在气相色谱-质谱法 (GC-MS) 中,气相色谱法用于根据样品中挥发性化合物的沸点进行分离,然后再将其送入质谱仪。这种组合非常适合分析小有机分子、环境污染物以及精油或石化产品等复杂混合物。
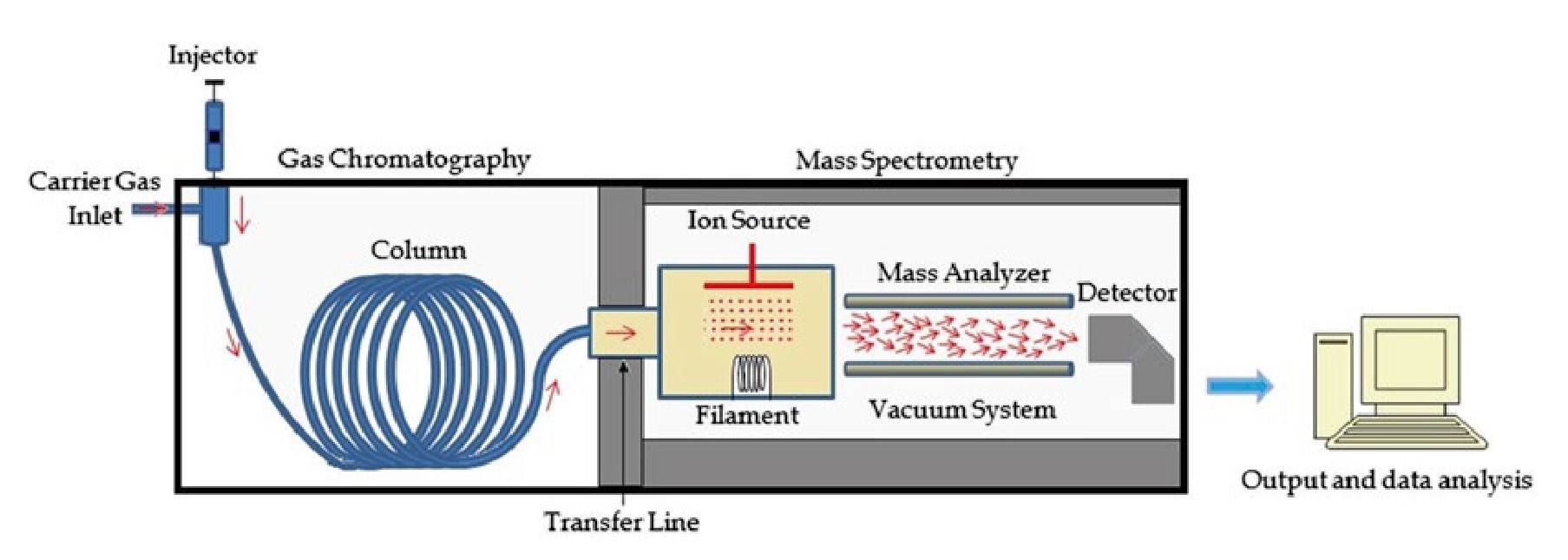
图 3 GC-MS 系统图
3.2液相色谱-质谱法 (LC-MS):LC-MS 用于分离液体中的非挥发性化合物,包括蛋白质、肽和药物,然后再进行质谱分析。高效液相色谱法 (HPLC)通常与 MS 配合使用,用于分析复杂的生物样品和药物代谢物。
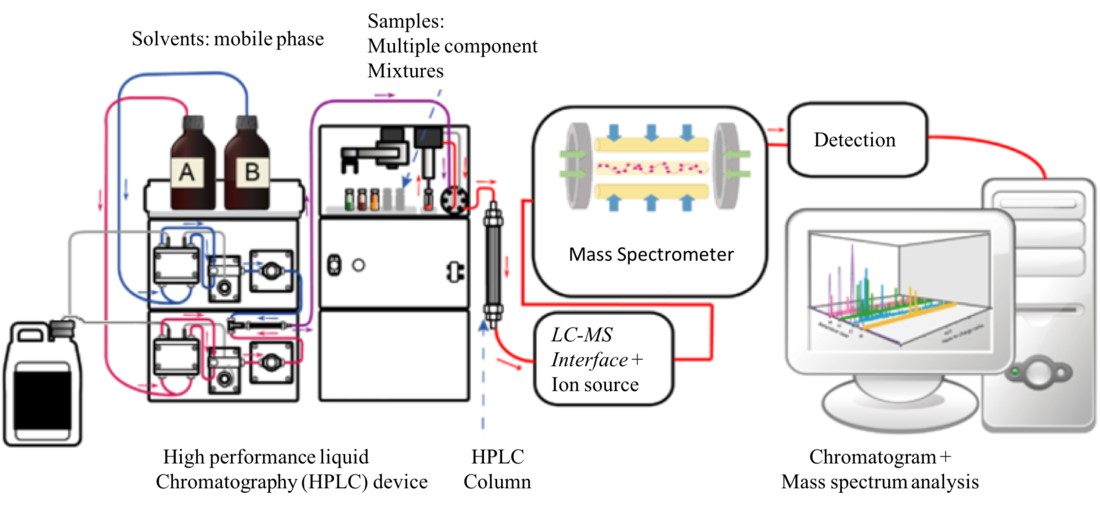 图 4.LC-MS 系统图
图 4.LC-MS 系统图
3.3毛细管电泳质谱法 (CE-MS):CE-MS 是一种强大的技术,可根据带电物质(例如肽和核苷酸)的尺寸和电荷,在电场中分离它们。该方法在蛋白质组学和生物分子分析中尤其有用。
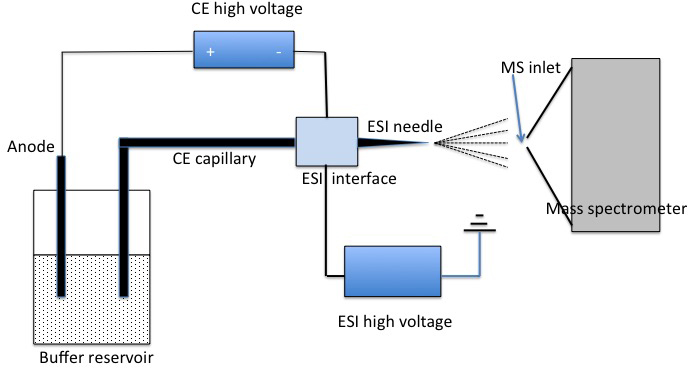 图 5. CE-MS 系统图
图 5. CE-MS 系统图
四、质谱应用
质谱法已成为结构生物学中不可或缺的工具,为了解蛋白质、核酸和脂质等生物分子的结构、动力学和相互作用提供了关键信息。质谱法在结构生物学中的一些关键应用包括:
蛋白质鉴定与表征:质谱法广泛应用于蛋白质组学,通过分析肽片段来鉴定和表征蛋白质。串联质谱法 (MS/MS)可以对肽段进行测序,并将其映射回相应的蛋白质序列。这对于理解蛋白质功能、翻译后修饰和相互作用至关重要。
蛋白质-蛋白质相互作用的测定:交联质谱法 (XL-MS)是指在相互作用位点对蛋白质进行化学交联,然后用质谱分析交联复合物。这可以提供有关蛋白质-蛋白质相互作用位点的宝贵信息,并有助于构建复杂分子结构模型。
自上而下的蛋白质组学:自上而下的蛋白质组学是指直接用质谱分析完整蛋白质,无需事先消化成肽段。这种方法可以详细研究蛋白质异构体、翻译后修饰和更高级的结构。它尤其适用于表征抗体等复杂蛋白质。
氢-氘交换质谱 (HDX-MS):HDX-MS 通过测量蛋白质主链中氢原子与溶剂中氘原子的交换来研究蛋白质折叠和动力学。通过比较蛋白质不同区域的交换速率,科学家可以推断出蛋白质二级和三级结构的信息。
天然质谱法:天然质谱法可以分析天然、非变性状态下的生物分子。该技术用于研究功能状态下的大型蛋白质复合物、核酸和膜蛋白,从而深入了解它们的结构、化学计量和相互作用。
总而言之,质谱法是一种用途广泛且功能强大的分析工具,在过去一个世纪中发展成为现代科学,尤其是在结构生物学领域的重要仪器。它能够根据质荷比对离子进行电离、分离和检测,从而能够对复杂的生物分子进行详细研究,在蛋白质鉴定、表征和相互作用研究等应用中具有不可估量的价值。当质谱法与气相色谱和液相色谱等分离技术结合使用时,它能够在分子结构分析中提供无与伦比的分辨率和准确度,从而为理解生物过程的控制机制提供深刻的见解。
五、常见问答
主要区别在于测得离子质量数的精确度,低分辨只能到整数位或者小数点后一位,而高分辨分可以到小数点后两位或六位;高分辨质谱能够将分子量相差很小的两种物质进行区分,从而准确推断分子元素。
正、负离子模式是质谱的两种扫描模式,样本在ESI源离子化之后,会同时出现带正电荷和负电荷的离子,根据物质的理化性质的差异,有些产物会带上正电荷有些会带负电荷。
选择哪种模式,要看结构里是否含有孤对电子易得质子的基团,如-NH2、-OH(正离子模式),或易失去质子的基团,如-COOH(负离子模式),有的化合物正负离子都可以测,例如核苷酸。
质谱一般用于有机分子的鉴定分析,无机物建议用ICP-MS、离子色谱(IC)、化学滴定等手段分析。
电喷雾源(ESI)、大气压化学电离源(APCI)、大气压光学电离源(APPI)、电子轰击源(EI)、化学电离源(CI)、基质辅助激光解析电离源(MALDI)。常用ESI、APCI、EI;ESI为软电离,基本不产生碎片峰,适用于分析极性强的大分子有机化合物;APCI源会产生准分子离子峰,几乎不产生碎片,主要用来分析中等极性或低极性的小分子化合物;EI为硬电离,会产生丰富的碎片离子(但分子离子峰比较弱很难被捕捉),主要用于挥发性样品。
可能是由于离子源选择不合适,也可能是因为样品纯度太低,未检出。
 感谢点赞
+1
感谢点赞
+1





