紫外可见光谱原理
360 0
光谱学是对样品的离子、原子或分子从一种能态转变为另一种能态时发射或吸收的电磁辐射的测量和解释。
紫外-可见光谱法 紫外-可见光谱法是一种吸收光谱法,利用电磁辐射光谱中紫外范围和邻近可见范围内的辐射。吸收波长主要在 100 - 700 nm 之间。
 紫外可见光谱原理
紫外可见光谱原理
- 光谱学的定义是光与物质的相互作用。
- 当光被物质吸收时,分子或原子的能量含量就会增加。
- 材料的吸收光谱取决于材料的分子和原子组成。
- 物质吸收光的频率取决于分子两种能态之间的能量差。
- 当辐射被吸收时,电子将从基态激发到更高的能态。
- 吸收导致吸收线的形成,该吸收线与其他线一起形成吸收光谱。
- 分光光度计的入射光处于电磁辐射的可见光和紫外光谱范围内。
- 当具有足够能量的光子到达物体时,物体接收并吸收能量,从而使电子达到更高的能态。
- 吸收的辐射或光子的量导致吸收光谱的形成,这将以吸光度来测量。
- 化合物的吸光度取决于来自基态的激发电子的数量,这取决于样品中的分子浓度或数量。
- 化合物对辐射的吸收会产生独特的光谱,这有助于作为化合物的标记或标识符。
- 电子越容易被激发,化合物能够吸收的光的波长就越长。
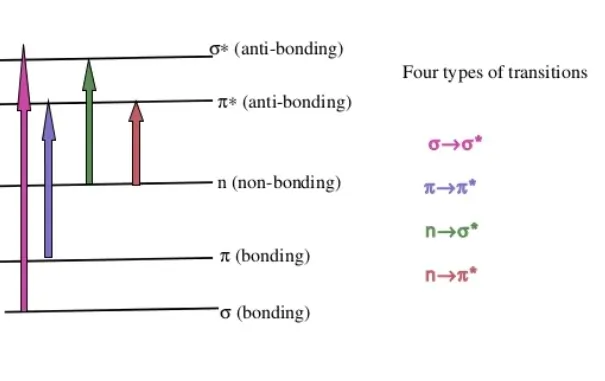
- 可以观察到四种可能类型的相互作用或转换。它们是 (π–π*、n–π*、σ–σ* 和 n–σ*)。根据能量的相互作用顺序如下:σ–σ* > n–σ* > π–π* > n–π*。
- 光谱源于分子中电子从较低能级跃迁到较高能级。
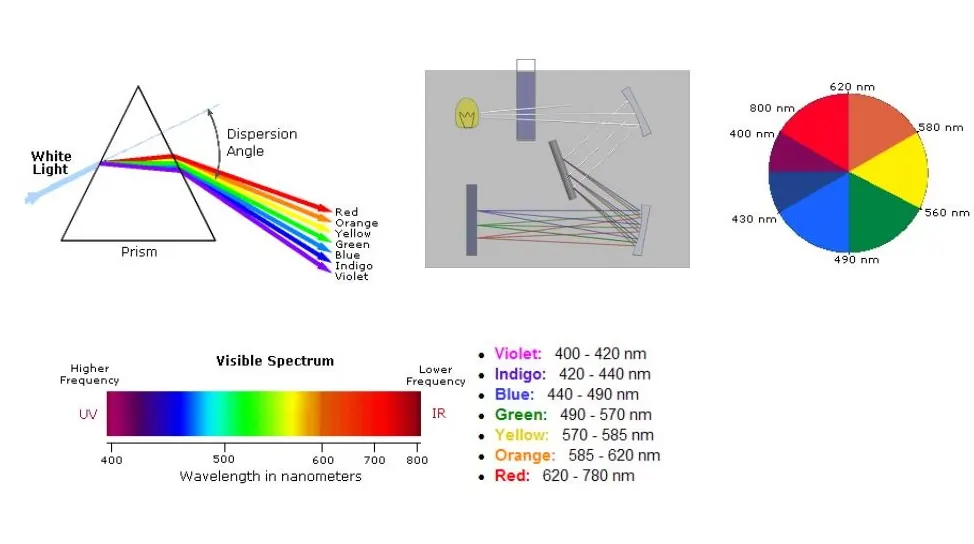
- 在可见光范围内,辐射的能量为36-72 kcal/mol,但在紫外线范围内,辐射的能量高于143 kcal/mol。
- 分光光度计能够记录样品在紫外线和可见光波长范围内不同波长的吸收量。
- 吸光度 (A) 与波长 (ƛ) 的关系图称为光谱。
- 电子能级之间的跃迁导致光谱中 200-900 nm 区域的电磁辐射的吸收。
- 在激发过程中,分子键中的原子合并形成分子轨道,这些轨道被不同能级的电子占据。电子从最高占据分子轨道 (HOMO) 激发到最低占据分子轨道 (LOMO)。产生的点称为激发态或反键态。
- σ–σ*跃迁是需要较大能量才能发生的跃迁。一个例子是甲烷,它有一个单键 CH。并在 125 nm 处显示出最大吸收。
- n–σ* 跃迁所需的能量比 σ–σ* 跃迁少。吸收峰出现在 200 nm 以下,具有未共享电子的原子的饱和化合物会经历此跃迁。例如水和乙醇。
- π–π* 和 n–π* 转变需要不饱和官能团的出现。烯烃和炔烃是 π–π* 转变的例子,而羰基化合物是 n–π* 转变的例子。
吸光度定律
与紫外可见光谱原理相关的吸光度定律有两条,即比尔定律和朗伯定律。
比尔定律
单色光束的强度随吸收物质浓度的增加而呈指数下降。但该定律仅适用于稀溶液。
朗伯定律
当一束光穿过透明介质时,强度随介质厚度的减小率与光的强度成正比,相互作用的程度取决于收缩,收缩与吸光度之间偏离了线性关系。
限制
- 散射和反射可以改变报告的吸收率。
- 与溶剂反应
- 高浓度影响电荷分布,离子之间的平均距离减小,使得粒子彼此靠近。
- 存在杂散光
结论
电子基态和激发态之间的能量差总是等于它吸收的辐射量。吸收的能量在溶液中以热量的形式出现。因此,以上段落阐明了紫外可见光谱原理的知识。
 感谢点赞
+1
感谢点赞
+1





